Der er i disse år stor nervøsitet for og opmærksomhed på udbredelsen af antibiotikaresistens. I stærk kontrast til det står opmærksomheden på biofilminfektioner. Til trods for, at de i samlet omfang er mere udbredte og et aktuelt og stigende problem – og også kendetegnes ved svigt af antibiotikabehandlinger. Det skønnes, at op i mod 60-70 % af bakterielle infektioner på sygehusene skyldes, at bakterier danner biofilm.
Betændelse i hjertet, kroniske lungeinfektioner, plak på tænder, ikke helende sår, infektioner på ortopædiske proteser, øredræn og karproteser, m.fl. Dertil kommer en mangfoldighed af andre mikrobiologiske tilstand.
På trods af det kliniske omfang skyldes den relativt manglende opmærksomhed på biofilminfektioner formentlig netop deres enorme diversitet. Den ekstreme spredning medvirker til, at omfanget af biofilminfektioner ikke for alvor erkendes – de er ’overalt’, men dominerer ikke i antal i det enkelte medicinske speciale bortset fra tandlægeområdet.
Ikke desto mindre medfører biofilm i udtalt grad tolerance overfor antibiotisk terapi og behandlingssvigt, hvis ikke behandlingen indrettes efter mikroorganismernes biofilm-egenskaber. Og de er desværre slet ikke kendte nok endnu.
Ung og ukendt
Selvom Antonie van Leeuwenhoek for over 300 år siden observerede og beskrev, hvordan mikroorganismer i afskrab fra tænder overlevede, hvis de var inderst i materialet, mens overfladisk beliggende mikroorganismer døde, er medicinske biofilminfektioner stadig en relativt ung forskningsdisciplin. Den blev først for alvor præsenteret i den kliniske verden for 40-45 år siden. Natur- og miljømikrobiologer har derimod kendt til begrebet i næsten 100 år, ligesom de tekniske videnskaber tidligt fangede interesse for mikrobielle biofilm.
Med en stigende klinisk erkendelse af vigtigheden af biofilminfektioner er der et enormt behov for at udnytte den store viden skabt i tekniske videnskabeligt regi og at få testet hypoteser med basis i kliniske observationer og viden i modelsystemer – både i laboratoriet og i levende organismer.
Men afstanden mellem videnskaberne er betragtelig. Meget få videnskabeligt aktive klinikere og basalvidenskabelige forskere arbejder henover denne kløft, og der mistes nyttig viden pga. utilstrækkelig forskning på området – både hypotesebaseret grundvidenskab og den anvendte, translationelle, forskning.
De savnede løsninger skal findes og testes i dette krydsfelt og vil derfor markant gavnes af bedre klinisk orienterede videnskabelige muligheder, på tværs af de mange typer af biofilm, så det kan tages hensyn til mangfoldigheden i biofilmproblematikken – de forskellige bakterier eller svampe, der angriber forskellige organer eller fremmedlegemer som fx proteser.
Sammen bliver de stærke
Den almindeligt kendte vækstform af mikroorganismer er individuel planktonisk vækst, som bl.a. ses i laboratoriekolber med flydende dyrkningsmedier. Biofilm, derimod, er større aggregater af mikroorganismer – bakterier eller svampe – organiseret i og omgivet af en selvproduceret polymer-matrix.
Aggregaterne består bl.a. af lange kæder af forskellige sukkerstoffer – de såkaldte exopolysaccharider – ekstracellulært DNA (eDNA) og andre produkter såsom lipopolysaccharid, proteiner og peptidoglykan, der udskilles, fx når bakterier dør. Matrixen kan også indeholde bestanddele fra omgivelserne, herunder værtsfaktorer ved kliniske biofilm.
Biofilmene er kendetegnet ved betydelige gradienter fra overfladen (med samme forhold som de umiddelbare omgivelser) og ind mod centrum af biofilmen, hvor iltkoncentrationen kan være meget lav og substrater begrænsede. Biofilmene er også karakteriseret ved, om de adhærer eller klæber sig til kunstige overflader eller vævsoverflader eller simpelthen er opstået i væv eller vævssekreter.
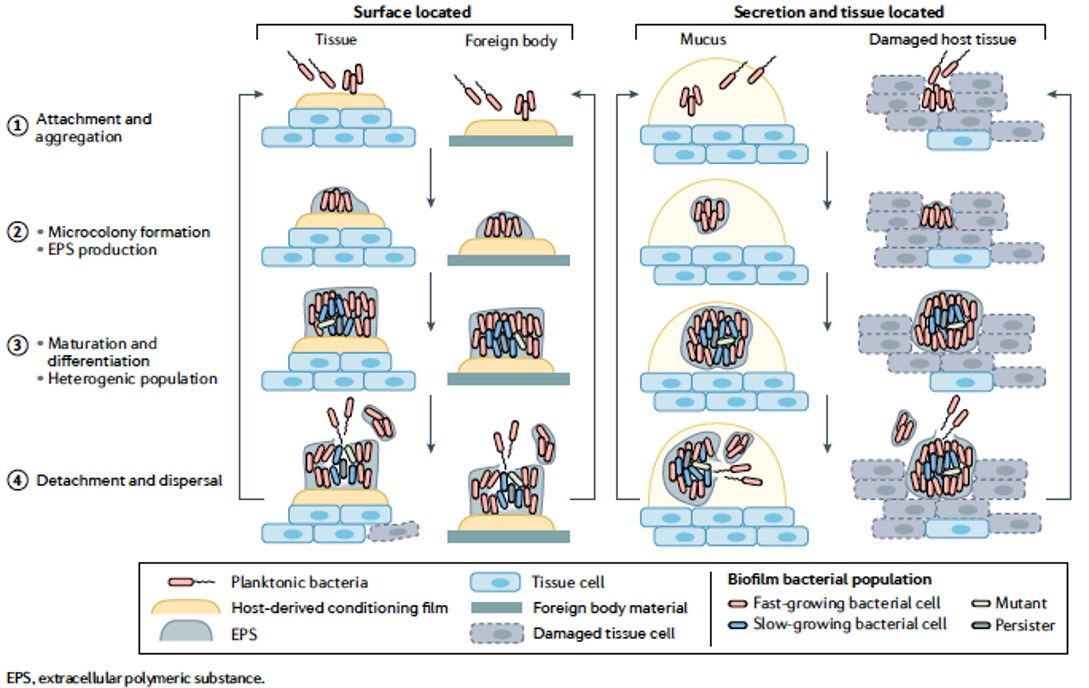
Biofilm er en organiseret form (aggregater) af en bakteriepopulation med forskellige egenskaber sammenlignet med en såkaldt planktonisk population af tilsvarende størrelse. (Fra Nature Reviews Microbiology)
Når tolerance ikke er godt
Den alvorligste konsekvens af biofilm i kroppen er den medfølgende fysiologiske tolerance overfor antibiotika, immunsystemet og desinfektionsmidler. Den opståede tolerance er ofte ikke marginal men kræver, at mængden af antibiotika skal øges til høje koncentrationer for at kunne eliminere de biofilmvoksende mikroorganismer.
Hvis de nødvendige doser blev givet som systemisk behandling – i hele kroppen fremfor lokalt – ville lægemidlerne være giftige for patienterne.
Også immunsystemets forsvarssystemer – effektorfunktioner såsom leukocytter, antistoffer og komplementsystemet – fører til skader i det omgivende væv fremfor eliminering af biofilmen og kan føre til tab af organers funktion.
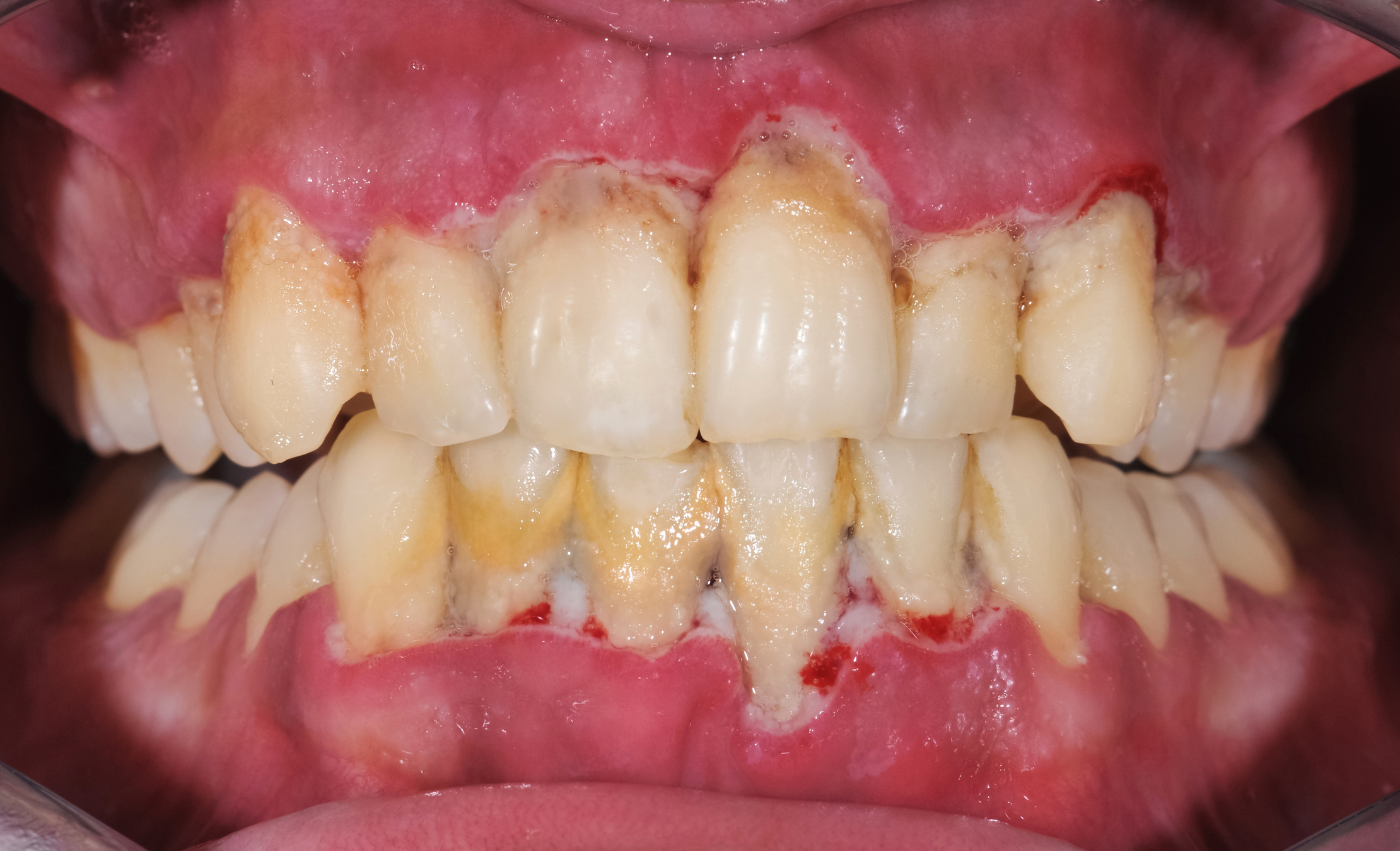
Denne følgeskade kan føre til tab af tænder ved periodontitis, løsning af hofte- og knæ-proteser, lungeskader ved inficerede cystisk fibrose-patienter, manglende heling hos patienter med kroniske bensår og diabetiske fodsår – eller destruktion af hjerteklapperne hos patienter med hjerteklapinfektion.
Biofilm kommer sovende til successen
Biofilms ekstreme modstandsdygtighed kan betragtes som en urgammel overlevelsesstrategi hos mikroorganismer, og den er langt mere universel end fx sporedannelse, som kun findes hos ganske få humanpatogene bakteriearter. Den tolerance, en bakterie kan opnå ved at danne biofilm, findes formentlig hos alle bakterier og svampe, bortset fra de såkaldte obligat intracellulære bakterier.
Mekanismerne bag toleranceudviklingen er multifaktoriel, men den nedsatte mikrobielle aktivitet i de centrale dele biofilmene er måske vigtigst. Den resulterer i en dvale-lignende tilstand af mikroorganismerne, ofte benævnt ’dormant’ types’.
De fleste antibiotika er nemlig afhængige af, at mikroorganismerne er i aktivitet for optimal effekt. Hvis bakterierne derimod nedsætter deres vækst til fx 1/10 af deres normale væksthastighed, kræver det ti gange længere tids behandling at dræbe bakterierne – altså behandlingslængder, der kun vanskeligt gennemføres. Søvn udgør på den måde selve grundlaget for biofilms succes.
Translationel klinisk succes
Første gang, man klinisk opdagede biofilminfektion, var i de kroniske lungeinfektioner – med bakterien Pseudomonas aeruginosa – hos patienter med den arvelige sygdom cystisk fibrose. De regnes derfor i dag som model for og har dannet basis og inspiration for undersøgelser af en række andre kroniske infektioner og nye behandlingsmuligheder.
Det drejer sig om:
- kombinationsbehandlinger for forbedret antibakteriel effekt og forebyggelse af egentlig resistensudvikling,
- antibiotikainhalationsbehandling med henblik på at opnå høje koncentrationer i de øvre luftveje,
- sub-inhibitoriske effekter påvirkende bakteriernes virulens,
- vedligeholdelsesbehandling for at undertrykke infektionen,
- DNAse-behandling, der kan nedbryde DNA fra hvide blodlegemer i mucus og eDNA i biofilm-matrixen.
Og hvad har kendetegnet denne succes? Den translationelle og tværfaglige tilgang – det tætte samarbejde med børnelæger og kliniske mikrobiologer og senere infektionsmedicinere og øre-næse-halslæger. Men også det tætte samarbejde med Københavns Universitet og de tekniske videnskaber, ikke mindst DTU, der med forskellige avancerede teknologier har givet indsigt i fx udviklingsstadier og nicher i biofilm og molekylære baggrunde for observationer.
Relevante modelsystemer i dyr til testning af hypoteser har været en stor del af forklaringen – in vivo veritas! De personlige relationer i samarbejdet og den konstante opgørelse og publicering af erfaringerne har også været vigtige.
Sårheling og infektioner på hjerteklapperne
Baseret på andres observationer, men også baseret på vores egne resultater vha. af en dyremodel og en in vitro-simulationsmodel, er det lykkedes os at vise, at infektioner på hjerteklapperne, endokarditis, er en biofilminfektion.
Ved at anvende biofilmprincippet om kombinationsbehandling medvirkede vi til at vise, at patienter med endokarditis kan skifte til tabletbehandling og i gennemsnit komme hjem fra hospitalet 16 dage tidligere, ovenikøbet med bedre langtidsoverlevelse end ved intravenøs antibiotisk behandling under indlæggelse.
Dyreeksperimentelt har vi vist, at hyperbar iltbehandling, såkaldt ’trykkammerbehandling’, forbedrede bakteriedrabet på hjerteklapperne og mindskede inflammationen. Det resulterede i et klinisk studie af trykkammerbehandling af endokarditpatienter – et translationelt og tværfagligt samarbejde med hjerteafdelingerne på Herlev Hospital og Rigshospitalet og trykkammerenheden på Rigshospitalet. Resultaterne analyseres i øjeblikket.
Endokarditis opstår som følge af celleskader, såkaldte endothelskader, på hjerteklapperne. Skader som igangsætter en helingsproces via kroppens trombocytter, fibrin og leukocytter. Præcis denne sammensætning kan også opnås i biologiske plastre dannet ud fra blod via en speciel form for centrifugering. Placering af disse autologe plastre i patienters egne ikke helende sår har vist at fremme helingen.
Men endothelskaderne gør også, at hjerteklappen er mere udsat for bakteriel kolonisering. In vitro-kolonisering med relevante endokarditis-bakterier har vist sig at fungere overbevisende som en endokarditis-simulationsmodel og skal nu testes for, om den kan afspejle det individuelle patientforløb ved at teste en patients givne behandling på en simulering baseret på patientens eget blod og inficerende bakterier.
Modellen skal sideløbende bruges til at identificere ny og forbedret behandling til patienter med infektion på hjerteklapperne.
Virker det ét sted, virker det måske også…
Fugles vigtigste antistof hedder IgY. Det findes i stor koncentration i æggeblommen (Y for yolk) og gurgling med blommen fra høns vaccineret mod P. aeruginosa har i åbne studier vist at kunne forebygge opblussen af lungeinfektioner af P. aeruginosa hos cystisk fibrose-patienter.
Vi har vist en endnu bedre behandlingseffekt af IgY ved at kombinere det med antibiotikaet azithromycin. En sådan strategi i forebyggende cystisk fibrose-behandling er nu overhalet indenom af de nye og ekstremt lovende CFTR-modulatorer og potentiatorer. Men kombination kan nu måske finde anvendelse til behandling af KOL og bronkiektasipatienter.
Det, der virker mod en biofilm, kan tilsyneladende også bruges mod en anden, baseret på devisen om, at virker noget på én slimhinde, kan det måske også virke på en anden. Vi har netop påvist en forbyggende effekt af anti-Pseudomonas IgY mod kronisk urinvejsinfektion i en nyudviklet dyremodel. De kliniske målgrupper er patienter, hvor urinvejsinfektioner er et udbredt problem. Dette gør sig specielt relevant for rygmarvsskadede patienter, der er afhængige af kateteriseringer af urinvejene flere gange dagligt, men også patienter på intensivafdelingerne kan være kandidater til denne strategi.
P. aeruginosa er oplagt som målbakterie grundet sine biofilmevner, generelt nedsatte antibiotikafølsomhed og udbredte evne til resistensudvikling, men IgY-behandlingen kan relativt let rettes mod andre uropatogener også – vaccinering af høns med andre uropatogener kan nemt gennemføres.

Et translationelt ingenmandsland
Klinisk rettet translationel forskning kan, firkantet sagt, lande i kløften mellem patienthåndtering og den basalvidenskabelige og tekniske forskning. Lige dér, hvor forståelsen ikke er god nok for kompleksiteten af fx dyremodeller, og hvor meget arbejde der ligger i at sikre deres relevans og reproducerbarhed. Der, hvor den basalvidenskabelige forskning har en naturlig og begrænset indsigt i kompleksiteten i patientbehandling og af klinisk afprøvning af nye behandlingsmuligheder.
Det er næsten et ingenmandsland, men med tætte tværsektionelle samarbejder og forståelse for kompleksiteten og diversiteten af biofilminfektioner kan der gøres helt nye og nødvendige kliniske fremskridt, også på tværs af biofilmene, til gavn for patienterne.
Med tanke på den enorme succes, cystisk fibrose-behandlingen har været i Danmark og hvordan den har været lokomotiv for hele verden, og at der er endog meget stærke videnskabelige biofilmfokuserede forskningsmiljøer i Danmark med internationale samarbejder, bør vi kunne komme langt videre indenfor en række andre biofilmrelaterede sygdomme og dermed også trække andre med.
Vi er på vej med hensyn til de kroniske sår, urinvejsinfektioner og de betændte hjerteklapper, men potentialet er langt, langt større. Så vi er ikke hjemme endnu – vi skal videre!
